[편집자주] 파이낸스스코프는 단독성 기사, 인사이트 등을 담은 내용을 유료로 제공하고 있습니다. 유료 출고시 제목은 '프리미엄 회원에게만 제공되는 기사입니다'로 표시되고 제목은 본문에 제공합니다. 대부분의 인사이트는 유료로만 제공하며, 일부 기사도 유료 서비스만 합니다. 또한 유료기사의 무료 전환시 기사의 제목을 재배치하고 공개됩니다.

앱클론 파트너사 헨리우스가 HER2 항체 후보물질 ‘HLX22(AC101)’의 위암 1차치료제 세팅 임상3상에서 이점을 보인 결과를 내놨다.
표준치료제인 HER2 항체 ‘허셉틴’과 화학요법 병용요법 대비 무진행생존기간(PFS)와 전체생존기간(OS)에서 이점을 보였다.
HLX22는 앱클론이 지난 2016년 헨리우스에 라이선스아웃(L/O)한 항체 신약이다. 허셉틴과는 HER2에 결합하는 부위가 다르다.
23일 미국 임상종양학회(ASCO) 홈페이지에 공개된 초록에 따르면 헨리우스는 HLX22의 HER2 양성 위암 1차치료제 세팅 임상3상 결과를 업데이트해 밝혔다.
헨리우스는 국소진행성 또는 전이성 HER2 양성 위암(G/GEJC) 환자를 대상으로 임상을 진행했다. 임상은 이전에 전신 항암치료를 받은적 없는 환자를 대상으로 HLX와 위약을 투여해 진행됐다. 임상참여자는 모두 표준치료인 ‘허셉틴+젤록스(XELOX)’를 투여받았다.
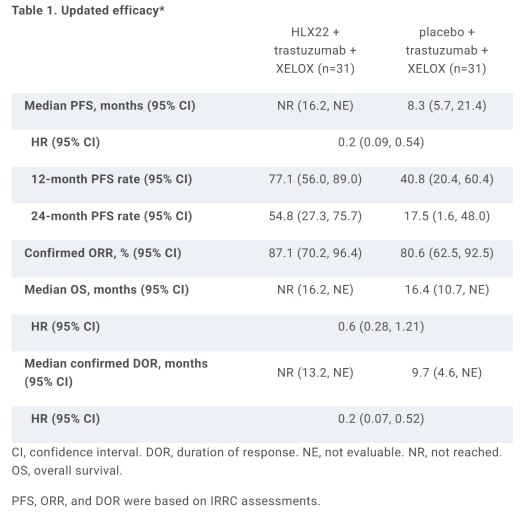
분석시점 기준으로 HLX22 투여군(31명)의 무진행생존기간 중앙값(mPFS)는 중앙값에 도달하지 않았다. 위약군(31명)에서는 8.3개월로 나타났다(HR: 0.2).
HLX22와 위약군에서 24개월차 PFS 비율은 각각 54.8%, 17.5%, 12개월차에는 각각 77.1%, 40.8%를 보였다.
전체생존기간 중앙값(mOS)와 반응지속기간 중앙값(mDOR)은 HLX22 투여군에서 중앙값에 도달하지 않았다. 위약군에서는 각각 16.4개월(HR:0.6), 9.7개월(HR:0.2)로 확인됐다.
안전성 프로파일도 관리가능한 수준으로 나타났다.
치료관련 부작용(TEAE)는 HLX22와 위약군에서 각각 96.8%(30명), 100%로 보고됐다. 3등급 이상 부작용은 HLX22와 위약군에서 각각 54.8%(17명), 48.4%(15명)이었다.
위약군에서 HLX22 또는 위약 관련 부작용으로 사망사례 1건이 발생했다. 또한 HLX22와 위약군에서 각각 1명씩 HLX22/위약 관련 부작용으로 임상을 중단했다.
헨리우스 연구진은 “HLX22와 허셉틴+젤록스 병용요법은 HER2 양성 G/GEJC 환자에게 생존기간 향상과 관리가능한 안전성을 보였다”고 분석했다.