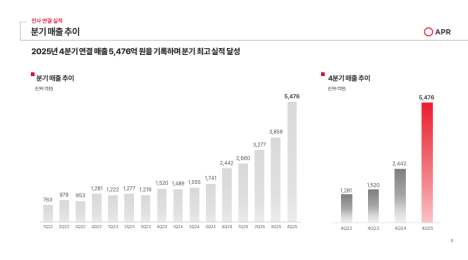
엘앤씨바이오는 8일 자사의 스킨부스터 ‘리투오(Re2O)’ 거래처가 1000곳을 돌파하며 피부 재생 전문 기업으로의 변화를 가속화하고 있다고 밝혔다.
기존에는 메가덤·메가카티 등 인체조직 이식재를 중심으로 한 의료기기 기업으로 알려졌지만, 최근에는 ECM(세포외기질) 기반 리투오를 앞세워 사업 정체성을 새롭게 구축하고 있다.
지난해 11월 출시된 리투오는 의료 현장에서 빠르게 확산되고 있다. 8월 기준 거래처는 직거래처와 휴메딕스 협업 채널을 합쳐 약 1000곳에 달하며, 회사는 연말까지 2000곳 이상 확보를 목표로 하고 있다. 의료진 사이에서는 ECM을 직접 보충하는 방식이 기존 스킨부스터와 다른 차별적 피부 재생 메커니즘으로 평가받으며, 제품 신뢰와 수요가 함께 확대되는 추세다.
엘앤씨바이오는 리투오와 동일한 ECM 기전을 가진 의료기기 버전 개발을 완료했으며, 향후 2년 내 출시를 계획하고 있다. 인체조직 기반 제품인 리투오가 해외 인허가 절차에서 까다로움을 겪는 반면, 의료기기 버전은 허가 장벽이 낮아 글로벌 시장 확장에 유리하다는 판단이다.
국내에서는 리투오가 임상 효과와 입소문을 통해 시장을 견인하고 있으며, 해외에서는 리투오와 의료기기 버전을 병행해 각국의 규제 환경에 맞춘 전략적 확장을 추진한다. 최근 수요 급증으로 일시적 품절 현상이 발생했으나, 생산 체제를 2교대로 전환하고 리투오 전용 신규 제조소도 착공해 연말 허가를 목표로 하고 있다.
또한 원재료인 피부 도너를 다년간 안정적으로 확보해 현재 약 2000 도너(약 2년치 분량)를 보유하고 있다. 회사 추산에 따르면 리투오 단일 품목만으로도 내년 약 700억 원 규모의 시장 소화가 가능하며, 의료기기 버전이 더해질 경우 중장기 성장 모멘텀이 한층 강화될 것으로 전망된다.
해외 시장에서도 성과가 이어지고 있다. 동남아·남미 여러 국가에서 인허가 절차를 개시했으며, 싱가포르에서는 품목허가를 획득해 첫 글로벌 성공 사례를 만들었다. 중국에서는 2024년 말 100% 자회사로 전환한 엘앤씨차이나(쿤산 공장)를 통해 NMPA 허가를 준비 중이다. 이미 NMPA 허가를 받은 메가덤플러스와 함께 중국 시장 진출을 본격화할 계획이며, 최근에는 리투오 성과를 기반으로 현지 전략적 투자자(SI)와의 초기 논의도 진행됐다.
엘앤씨바이오 관계자는 “리투오의 의료기기 버전 개발과 함께 국가별 인허가 전략을 병행함으로써, 규제 환경에 따른 진입 장벽을 완화하고 시장 확대를 도모하고 있다”며 “이러한 전략은 중장기적으로 매출 성장과 사업 다각화에 기여할 수 있을 것”이라고 말했다.