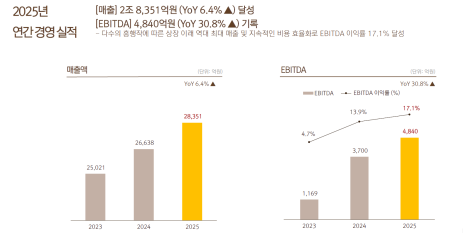
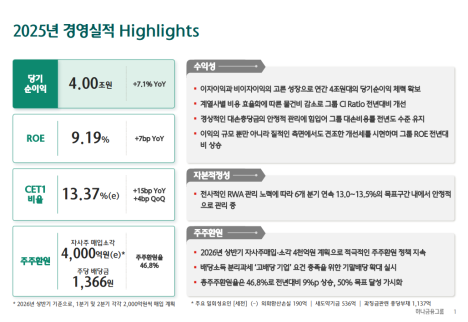
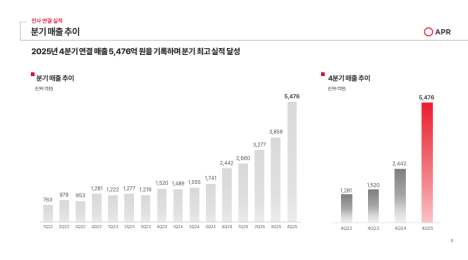
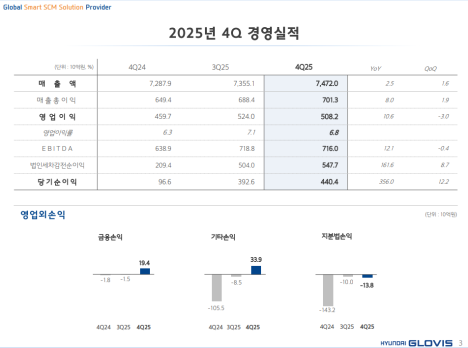
리가켐 바이오사이언스는 5일(현지시간) 넥스트큐어(NextCure)와 공동개발 중인 B7-H4 ADC ‘LNCB74’의 글로벌 임상 1상 고용량군 코호트 추가에 대해 미국 식품의약국(FDA)으로부터 승인받았다고 밝혔다.
LNCB74는 리가켐바이오와 넥스트큐어가 공동개발 중인 B7-H4 ADC다. 넥스트큐어의 암세포 특이적으로 과발현되는 B7-H4단백질을 표적하는 항체과 리가켐바이오의 차세대 ADC플랫폼과 MMAE 페이로드가 결합된 항암 신약이다. 미충족 의료수요가 높은 유방암 및 부인과암종(난소암, 자궁내막암 등)을 포함한 다양한 고형암을 주 적응증으로 글로벌 임상 1상을 진행 중이다.
이번 코호트 추가 승인은 MMAE 페이로드가 적용된 경쟁 B7-H4 ADC들 대비 더 높은 용량에 대해 FDA가 승인했다는 점에서 LNCB74에 적용된 리가켐바이오의 ADC 플랫폼이 지닌 우수한 안정성을 입증하는 사례라고 회사측은 설명했다.
실제로 앞서 리가켐바이오의 ADC 플랫폼이 적용된 HER2 ADC(LCB14), ROR1 ADC(LCB71) 등 다수의 임상 단계 ADC들의 임상 결과를 통해 동일 페이로드 계열이 적용된 ADC 내에서 독보적인 내약성과 유효성을 보였다.
LNCB74 또한 MMAE 페이로드가 적용된 B7-H4 ADC들 중 가장 높은 용량 진행에 대해 FDA가 승인했다는 점에서 긍정적으로 평가할 수 있다.
현재 LNCB74는 임상 1상 Part 1 ‘용량증대 연구(Dose escalation study)’가 진행 중으로 LNCB74의 안전성, 내약성 그리고 초기 항암 효과 확인을 진행 중이다.
지난 ASCO 2025에서 넥스트큐어는 LNCB74의 임상 1상 디자인에 대한 포스터 발표를 통해 0.5mg/kg부터 2.4mg/kg까지 4개 용량군으로 용량증대 연구를 진행한다고 했으나, 이번 FDA의 승인을 통해 추가적인 고용량군까지 확대 진행할 예정이다.
한편 현재 진행 중인 LNCB74의 글로벌 임상 1상에 대한 초기 유효성 입증 데이터(PoC)는 2026년 상반기 중 공개할 예정이다.