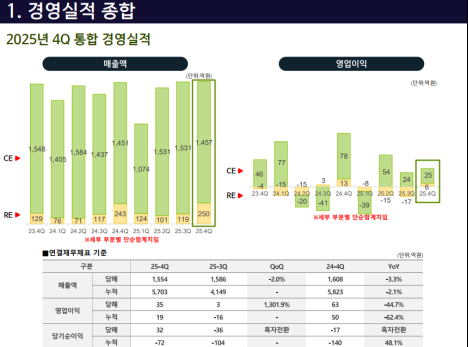
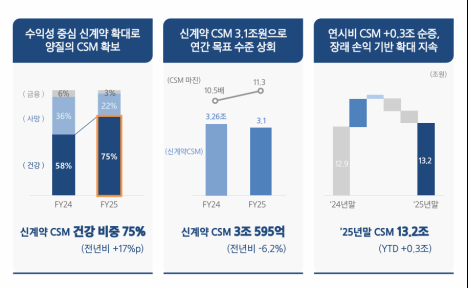
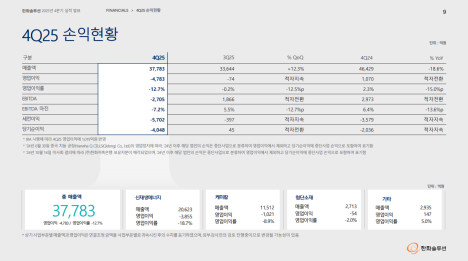
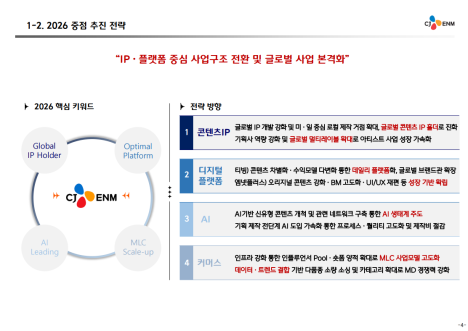
[편집자주] 파이낸스스코프는 단독성 기사, 인사이트 등을 담은 내용을 유료로 제공하고 있습니다. 유료 출고시 제목은 '프리미엄 회원에게만 제공되는 기사입니다'로 표시되고 제목은 본문에 제공합니다. 또한 무료로 전환시 기사의 제목을 재배치하고 공개됩니다.

에스티큐브가 개발중인 면역항암제 후보물질 ‘넬마스토바트(hSTC810)’이 식품의약품안전처에서 대장암 환자에 대한 치료목적 사용승인을 받았다.
치료목적 사용승인은 생명이 위급하거나 중대한 상황에 처한 상황에서 사용할 수 있는 치료옵션이 없는 환자에 한해 연구개발 중인 약물을 사용할 수 있도록 허가하는 제도다.
26일 식품의약품안전처 의약품안전나라에 따르면 에스티큐브의 넬마스토바트는 지난 24일 고려대병원에서 대장암 환자에게 사용하는 것을 목적으로 치료목적 사용승인을 받았다.
넬마스토바트는 BTN1A1을 타깃하는 면역항암제 후보물질이다.
에스티큐브는 최근 넬마스토바트의 연구자 주도 임상1b/2상 결과를 미국 면역항암학회(SITC 2025)에서 발표했다. 해당 임상은 이수현 고대안암병원 종양내과 교수 연구팀이 진행했다. 해당 임상에서 환자들은 넬마스토바트와 카페시타빈을 병용해 치료받았다.
데이터 컷오프 시점인 2025년 6월13일 기준으로 유효성 분석한 결과, 52명 중 PR 7명, SD 33명으로 확인됐다. 이에따른 ORR은 13.5%(7/52), DCR은 77.0%(40/52)를 기록했다. 무진행생존기간 중앙값(mPFS)은 4.2개월로 나타났다.
해당 결과에 대해 회사측은 “표준 치료에 실패한 3차 치료 이상의 전이성 대장암 환자에서 ORR 13.5%, mPFS 4.2개월이라는 결과는 기존 표준치료를 넘어서는 고무적인 임상결과”라고 설명했다.